AMPK y los cambios metabólicos después del
ejercicio.
En los párrafos
anteriores hemos visto que AMPK juega un rol importante en una serie
de mecanismos relacionados con el metabolismo muscular. Después del
ejercicio junto con la disminución de los niveles de Malonyl CoA, un
inhibidor de carnitina palmitil tranferasa1 (CPT1), AMPK posee un
rol importante en el metabolismo de las grasas. La acción descrita
hasta la fecha es que AMPK modula dicho metabolismo mediante la
inhibición o activación de las enzimas precusoras de MCoA, que son
MCD, malonyl CoA decarboxilasa y ACC, acetil CoA carboxilasa
respectivamente.
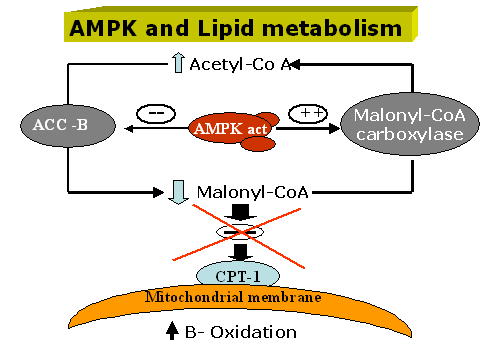
Ya en 1998
apareció una revisión en que se mencionaba a McoA como un regulador
muy potente de la oxidación de ácidos grasos durante el ejercicio y
MCoA a su vez estaba regulada por AMPK.En su parte final de dicha
revisión se dejaba constancia que 1) el aumento de
AMP originado por el trabajo muscular, activa AMPK, 2) La
fosforilación de AMPK, activa a ACC, 3) como consecuencia disminuyen
los niveles de MCoA y por lo tanto el efecto inhibidor sobre
carnitina lo que 5) aumenta la oxidación de ácidos grasos.
Tanto AMPK y MCD
están aumentada y ACC esta disminuida en músculo, hígado y tejido
adiposo después de 30 minutos de ejercicio. Todo este mecanismo
también ha sido corroborado mediante la aplicación de fármacos que
inciden sobre AMPK lo que indica el rol de esta proteína en la
regulación de los depósitos energéticos post esfuerzo. Esto implica
una gran importancia en los fenómenos que guardan relación con la
disminución de la adiposidad y en el aumento de la insulino
sensibilidad.
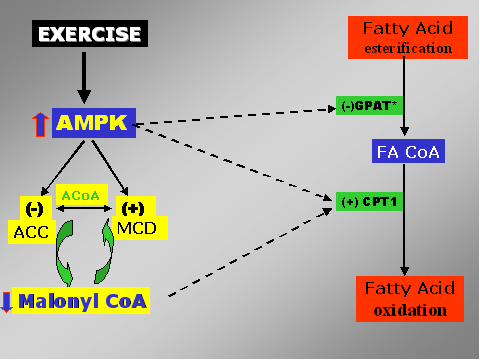
Como se puede
deducir, MCoA es un factor regulador potente de la oxidación de los
ácidos grasos. Este inhibidor de CPT1 disminuye significativamente
durante el ejercicio debido a la fosforilación de ACC y esta
reacción esta catalizada por AMPK, que es la enzima sensible a los
cambios de los contenidos de sustratos energéticos en los tejidos y
especialmente en el muscular.
Posterior al
ejercicio de mediana a alta intensidad, los niveles de AMPK en el
músculo esquelético, siguen elevados por un tiempo de mas de 60
minutos, lo que permite la resintesis de ATP mediante la
oxidación
de ácidos grasos con el objeto principal de restaurar los depósitos
energéticos de glicógeno lo mas rápido posible.(29)
En el hígado
también después del ejercicio en dosis especificas, se ha observado
un incremento de AMPK, fenómeno que no ha sido posible observar en
otras situaciones, lo mismo ha sido observado, con la actividad de
AMPK en el tejido adiposo. Por otro lado, glicerolfosato-aciltransferasa
(GPAT) que es estimulada por AMPK provocando una inhibición en la
esterificacion de ácidos grasos, también es reducida en hígado y
tejido adiposo pero no en musculo. Este fenómeno esta finamente
modulado por las sub unidades alfa 1 y 2 de AMPK, siendo esta ultima
mucho mas activada en el musculo que en el hígado o tejido adiposo.
Todo este mecanismo, una vez mas esta programado para favorecer la
oxidación de ácidos grasos en el musculo y disminuir la
esterificacion de estos en el hígado y tejido adiposo.
Es interesante
que estos fenómenos también han sido reproducidos con un fármaco
especifico para AMPK, llamado por sus sigla AICAR, lo que permite
corroborar el rol de AMPK en esta regulación
(30).
Hasta el momento
esta claro que AMPK es un sensor de los depósitos energéticos y que
su actividad se normaliza una vez que estos depósitos han recuperado
sus niveles normales, por lo que si bien existe un fármaco que pueda
activar AMPK, la magnitud del efecto del fármaco va estar en
relación al nivel de vaciamiento que hayan experimentado los
depósitos energéticos. Esta deducción deja en claro los efectos
benéficos del ejercicio en la metabolización de los ácidos grasos
producto de la estimulación de AMPK proveniente básicamente de la
depleción de los depósitos energéticos, principalmente los de origen
glucogénico.
Una evidencia de
esto quedo demostrada al observar un incremento de AMPK en ejercicio
muy prolongado y también en ejercicios breves pero de alta
intensidad, donde se tocan los depósitos de glicógeno de manera
importante.(31)
Otro rol, de los
varios que se están descubriendo de AMPK, es la de sensibilizar
algunos mecanismos relacionados con la incorporación de glucosa al
interior de la célula los cuales han sido dependientes e
independientes de insulina, ya que los cambios producidos por el
ejercicio, activan AMPK la cual por vía propia al parecer contribuye
a la translocación y transporte de los GLUT4. La relación de AMPK
también se ha observado con la estimulación de glucosa-6-fosfato un
activador de la glicogenosintetasa, lo que hasta hoy aun permanece
en discusión, pero si hay consenso en que la activación de AMPK
sensibiliza a la célula a la insulina mediante los mecanismos
descritos probablemente y esta sensibilización, he aquí lo
importante, permanece por varias horas después del ejercicio.
(32)
En definitiva
estamos frente a una proteína que cumple un rol básico en la
regulación del metabolismo energético, provocando cambios en el
hígado y tejido adiposo y también en el músculo, ya sea
incrementando la oxidación de ácidos grasos en el hígado y otros
tejidos y también estimulando la producción de glucosa hepática o
gluconeogenesis después del ejercicio contribuyendo a la
recuperación del desequilibrio o a la homeostasis post esfuerzo.
Finalmente se ha
podido observar que AMPK también es sensible a catecolaminas,
leptina y adiponectina, los cuales poseen relación directa entre
otras, con mecanismos de regulación del balance energético y en el
caso de catecolaminas en la estimulación de la lipólisis.
Las expectativas
de encontrar respuesta y solución a múltiples alteraciones
metabólicas, podría estar en la forma o manera de activar AMPK, ya
sea ejercicio u otro elemento estimulador, ya que en casos de
insulino resistencia, lipotoxicidad, obesidad, son situaciones que
están asociadas a un incremento en los depósitos de triglicéridos
intramiocelulares.
interacción y regulación de grasas y CH durante el ejercicio.
Sabemos que
hidratos de carbono (HC) y ácidos grasos (FFA) son los substratos
que intervienen en mas del 95% de la producción de energía aeróbica,
por lo que ambos substratos deben ser finamente regulados para
proveer los requerimientos energéticos. Uno de los mecanismos que
permite la mayor o menor contribución de uno u otro substrato al
metabolismo energético, va a depender de la disponibilidad de estos
en el plasma. Si los HC endógenos están elevados, van a desplazar
la utilización de FFA y también ocurre lo inverso (!).
De esta simple
situación emergen complejos mecanismos de regulación que abarcan
desde los niveles hormonales hasta las enzimas responsables de la
degradación y oxidación de cada uno de estos substratos. Para la
glucosa, se movilizan desde los GLUT4 para el consumo de glucosa
plasmática seguida por una fosforilación de hexokinasa estimulando
la glicogenolisis y luego la glicólisis mediante la activación de
fosfofructokinasa así se llega a la conversión de Acetyl CoA
mediante el aporte de la actividad de la piruvato deshidrogenasa.
Esta actividad relacionada con el metabolismo de la glucosa puede
inhibir el metabolismo de las grasas.
Por otro lado,
hablando del metabolismo de las grasas, hay un activación de los
transportadores de estas al interior de la célula muscular (translocasa
CD36) que mediante la lipasa hormono sensible permite la conversión
de estas en triglicéridos y así poder entrar a la mitocondria
mediado por el transportados carnitil palmitol transferasa.(33)
Desde esta
información básica veremos algunos de los mecanismos finos que
permiten la regulación e interacción metabólica de FFA e HC durante
el ejercicio.
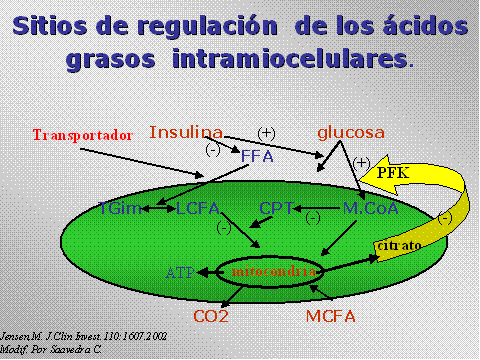
Uno de los
fenómenos descrito en la regulación del metabolismo de estos
substratos esta en el hecho de que una vez que existe un exceso de
glicógeno oxidado, producto de una oferta mayor y su gasto excesivo
puede traer un desbalance en la glicemia, esta descrito que una
parte del citrato producido en la mitocondria, tiene la capacidad de
ocupar el compartimiento extramitocondrial y su presencia en el
citoplasma, inhibe a fosfofructokinasa deteniéndose de esta forma la
glicólisis. Por otro lado la producción de acetil-CoA también posee
un efecto ya que inhibe la enzima mitocondrial, piruvato
deshidrogenasa. De esta forma se inhibe la utilización de glucosa y
glicógeno.
Cuando sucede lo
contrario, es decir, una gran oferta de grasas, los fenómenos de
inhibición del consumo de HC son mas complejos y los protocolos
experimentales son múltiples y variados.
La variedad en
los datos obtenidos se debe principalmente a que el glicógeno aporta
en ambos tipos de metabolismo, aeróbico y aeróbico mientras que las
grasas solo lo hacen en lo aeróbico.
Por otro lado el
exceso de ingesta de grasas puede jugar un rol en el desequilibrio
del consumo de estos substratos, favoreciendo el gasto de grasas en
ejercicio moderado, pero también cambia considerablemente la
acumulación de triglicéridos intracelulares los que juegan un rol
importante en el aporte energético en ejercicio de mayor intensidad.
En este proceso se ha podido constatar además que el consumo de
glicógeno disminuye pero el de glucosa no. Esto es en situaciones de
ejercicio agudo y de ingesta aguda, ya que la ingesta crónica, por
mas de 7 días, la acumulación de grasas intramiocelulares entorpece
la cascada de señales de insulina lo que en reposo disminuye la
incorporación de glucosa al musculo, mientras que en el ejercicio
este efecto no se produce debido a que los mecanismos de transporte
de glucosa, que se producen durante el ejercicio son independientes
de insulina.
también los
niveles de AMP, ADP y NADH, producidos por el metabolismo de las
grasas durante el ejercicio también podrían jugar un rol en la
regulación de los substratos utilizados durante el ejercicio
(34).
Debemos tener en
cuenta que este shifft o cambio que experimenta el musculo en
relación a la utilización mayor o menor de uno u otro substrato y
que es en parte dependiente de la disponibilidad en el plasma,
pierde validez cuando el ejercicio es intenso.
A estos estudios
no olvidemos agregar los entregados por la biología molecular en
relación a la acción de AMPK sobre la producción de M CoA el cual
también es inhibidor de la utilización de grasas dejando la
preferencia a los HC. Estos también en su actividad metabólica son
acompañados por un descenso del pH lo que se ha visto que también es
un inhibidor de CPT1. Por lo que estamos frente a un primer proceso
llevado a cabo por MCoA y reforzado por el descenso del pH como
elementos inhibidores del consumo de grasas o estimuladores o
favorecedores del consumo de HC. Este tema ha sido abordado
ampliamente mas arriba.
Me parece
oportuno hacer un paréntesis y señalar que nuestras características
de gasto metabólico “moderno” están basadas en poseer un cuociente
respiratorio en reposo mayor que el normal o deseado indicando
nuestra habilidad de metabolizar cada vez mas HC tanto en reposo
como en ejercicio moderado. Con los conocimientos otorgados por la
literatura, lo ideal seria poder volver a recuperar esa capacidad de
metabolizar en reposo y en nuestra actividad física habitual u
ordinaria la posibilidad metabolizar un mayor porcentaje de grasas
ante una misma intensidad de ejercicio, lo cual es posible
provocando un switch metabólico de los HC a los lípidos.
Este mecanismo
se efectúa fácilmente sometiendo al tejido muscular a una actividad
que permita un aumento de la biogénesis mitocondrial y/o en su
defecto un aumento de la actividad enzimática mitocondrial.
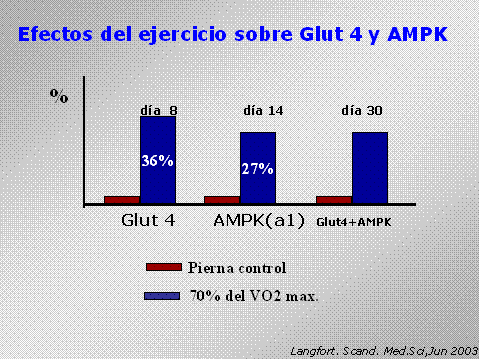
Uno de los
protocolos mas respetables es cuando en situaciones experimentales
se comparan las dos piernas de un mismo sujeto. Ambas piernas comen
lo mismo, duermen lo mismo y viven sus hábitos idénticamente durante
las 24 hrs., pero una es sometida a ejercicio. La pierna experimental
comparada con la control, reportan los datos mas convincentes en la
literatura científica.
Cuando una
pierna fue sometida a un vaciamiento importante de los depósitos de
glicógeno, esta pierna acumulo un 60% mas de glicerol en su interior
que la pierna control o no ejercitada. Esto demuestra que los
niveles de depleción de los depósitos energéticos, permiten
orientar, como mecanismo de defensa, los depósitos hacia uno u otro
musculo.(35)
Indudablemente que esta situación va a predisponer al musculo en
cuestión a una utilización de substratos diferente ante una misma
dosis de ejercicio.
No son pocos los
estudios utilizando esta misma vía experimental con los depósitos de
glicógeno y creatina o sobre los efectos de GLUT4 y AMPK.
Con todos
estos datos entregados en la presente revisión, creo que podemos
establecer ciertas directrices que nos permitirán una mejor
comprensión de los efectos del ejercicio sobre la salud.
Entendiendo por sobre manera que la masa muscular en el ser humano
juega un tremendo rol en la utilización de los substratos que
diariamente ingerimos y que difícilmente estamos gastando, por tal
motivo me permito terminar esta revisión diciendo una vez mas:
Estamos frente a un problema de
sarcopenia y de lipo-glicotoxicidad y nuestras enfermedades crónicas
modernas ya no son propias de los adultos sino que también de los
niños y básicamente porque estos se están moviendo como adultos.
Estamos genéticamente mal adaptados al medio ambiente que hemos
construido; por millones de anos el ser humano debía efectuar mucho
esfuerzo para conseguir su alimento y la maquinaria bio-energética
aun esta preparada PARA ESE ESTILO DE VIDA y si se mantiene sana
sirve como elemento protector de nuestra salud y todo en que medida
la utilicemos.
UN ESQUEMA GRAFICO DE CÓMO NUESTROS
DOS MALES PRINCIPALES SE POTENCIAN ENTRE SI.
(SAAVEDRA,C.
UKK Institut, Tampere, Finlandia, 2005)

Referencias
1.
Goodyear,L.J. 2000.
AMPK a critical
signaling intermediary for exercise-stimulated glucose transport.
Exercise Sport Sc. Review 28, 113-116
2.
Winder,W.W. 2001.
Energy-sensing and
signaling by AMPK in skeletal muscle.
J Appl. Physiol. 91, 1017-1028
3.
Hardie,D.G., Hawley,S.A. 2001.
AMPK the energy charge
hypothesis revisited.
Bioessays 23, 1112-1114
4.
Chen, Z.P., McConnell,G.K. 2000.
AMPK signal in
contracting human skeletal muscle: A
CoA carboxylasa
and NO synthase phosphorylation.
Am J.
Phsiol., E1202-E1206
5.
Musi, N., Fujii,N. 2001.
AMPK is activated in
muscle of subjects with type 2 diabetes during exercise.
Diabetes 50, 921-927.
6.
Bergeron,R., Previs, S.F. 2001.
Effects of AICAR
infusion in vivo on glucose and lipid metabolism on lean and obese
Zucker rats.
Diabetes 50, 1076-1082
7.
Mu,J., Brozinick,J. 2001.
A rol of AMPK in
contraction and hypoxia-regulated glucose transport in skeletal
muscle.
Mol Cell 7, 1085-1094
8.
Abbud, W., Habinowski, S. 2000.
Simulation of AMPK is
associated with enhancement of GLUT1- mediated glucose transport.
Arch.Biochem Biophys 380, 347-352.
9.
Higaki,Y., Hirshman,M.F., Fujii,N. and Goodyear,L.J. 2001.
Nitric oxide increase
glucose uptake through a mechanism that is distinct from the insulin
and contraction pathway in rat skeletal muscle.
Diabetes 50,241-247.
10.
Kawanaka, K., Nolte, L.A. and Hollozy, J.O. 2000.
Mechanisms underlying
impaired GLUT-4 translocation in glycogen-supercompensated muscle of
exercised rats.
Am
J Physiol 279, E1311-E1318.
11.
Ai, H., Ihlemann, J. 2002.
Effects of fiber type
and nutritional state on AICAR-and contraction stimulated glucose
transport in rat muscle.
Am J Physiol 282, E1291-E1300.
12.
Ihlemann, J., Galbo, H. 1999.
Calphostin C is a inhibitor of contraction ,but not insulin
stimulated glucose transport in skeletal muscle.
Acta Physiol. Scand. 167,69-75.
13.
Wojtaszewski, J.F.P., Lautsen,J., Richter,E.A. 1998.Contraction
and hypoxia-stimulated glucose transport in skeletal muscle is
affected differently by wortmannin. Evidence for different
signaling mechanisms.
Biochim Biophys Acta 1340, 396-404
14.
Nielsen,J.N., Wojtaszevski, J.F. 2002 Rol of AMPK in glycogen
synthasa activity and glucose utilization: Insights from patients
with McArdle’s disease. J. Physiol. 541, 979-989.
15.
Chen, H.C., Bandyopadhyay, G. 2002.
Activation of that ERK pathway in atypical protein kinase isoform
and AICAR stimulated glucose transport.
J Biol Chem 277, 23 554-23 562
16.
Somwar, R., Kim, D. 2001.
GLUT4 precedes the
stimulation of the glucose uptake in L6 cells: potential activation
of GLUT4 by p38.
Biochem J. 359, 639-649
17.
Meek, S, Jensen,M.1999. Insulin regulation of regional free fatty
acid metabolism. Diabetes 48, 10-14
18.
Burgera, B., Jensen,M. 2000.
Leg FFA kinetics during
exercise in man and woman.
Am J Physiol Endocrinol Metab. 278,E113-E117
19.
Guo, Z., Jensen,M. 2000.
Kinetics in
intramuscular trigliceride fatty acid in exercise human.
J
Appl Physiol 89, 2057-2064
20.
Hargreaves, M., Richter E. 1991.
Effect of increase
plasma fatty acid concentration on muscle metabolism in exercise man.
J Appl Physiol 70, 194-201
21.
Dyck, D., Peters, S. 1997.
Functional differences in lipid metabolism in resting skeletal
muscle of various fiber types.
Am J Physiol Endocrinol Metab 272, E340-E351
22.
Turcotte L.P, Richter E. 1998.
Contraction-induce
increase in Vmax. of palmitate uptake and oxidation in perfused
skeletal muscle.
J Appl Physiol 84, 1788-1794
23.
Spriet, L., Jones,L. 1986.
Endogenous
triacylglycerol utilization by rat skeletal muscle during titanic
stimulation.
J Appl Physiol. 60, 410-415
24.
Garvey,W., Baron,A. 1992.
Gene expression of
GLUT4 in skeletal muscle from SIR patients with obesity IGT, GDM
and NIDDM.
Diabetes 41, 465-475
25.
Goodpaster,B., Kelley,D.2000.
Thigh adipose tissue
distribution is associated with SIR in obesity and in type 2
diabetes mellitus.
Am J Clin Nutrition 71, 885-892
26.
Gan,S., Kraegen,E. 2002.
Altered myocellular and
abdominal fat partitioning predict disturbance in insulin action in
HIV protease inhibitor-related lipodistrophy.
Diabetes 451,3163-3169.
27.
Dobbins, R., Esser, V. 2001.
Prolnged Inhibition of
muscle carnitine promotes intramyocellular lipid accumulation and
SIR in rats.Diabets
50, 123-130
28.
Summers,S., Birbaum, M. 1998.
Regulation with
insulin-stimulated glucose transporter GLUT4 translocation and AKT
kinase activity by ceramide.
Mol Cell Biol 18, 5457-5464
29.
Wasserman, D., Davis,S..2002.
Fuel metabolism during
exercise in health and diabetes. Handbook of diabetes in exercise
Am
Diabetic.
Asoc.2nd E .63
30.
Park,H., Prentki,M. 2002.Coordinate
regulation of MCoA by AMPK during exercise.
J Biol Chem 277, 32571-32577.
31.
Carlson,C., Winder,W.1999.
Liver AMPK during and
after exercise.J
Appl Physiol, 86,669-674.
32.
Fisher,J.,Gao, J.2002.
Activation of AMPK
enhance sensitivity of muscle glucose transport to insulina.
Am J Physiol 282, E18-23
33.
Spriett, L., Odland, L. 1999.
Biochemical regulation
of CH and lipid interaction in skeletal muscle during low and
moderate intensity exercise.
Biochem Exercise.X 241. Human Kinetics.
34.
Stellingwerff,T., Spriet,L. 2003.
Effect of reduced FFA
on skeletal muscle during aerobic exercise.
Am J Physiol Endocrinol Metab 284:E538
35.
Blomstrang,E., Saltin,B. 1999.
Effect of muscle
glycogen on glucose, lactate and amino acid metabolism during
exercise and recovery in human subject.
J Physiol 514:293.
|










